Los procesos naturales estudiados por la química involucran partículas fundamentales (electrones, protones y neutrones), partículas compuestas (núcleos atómicos, átomos y moléculas) o estructuras microscópicas como cristales y superficies.
Desde el punto de vista microscópico, las partículas involucradas en una reacción química pueden considerarse como un sistema cerrado que intercambia energía con su entorno. En procesos exotérmicos, el sistema libera energía a su entorno, mientras que un proceso endotérmico solamente puede ocurrir cuando el entorno aporta energía al sistema que reacciona. En la gran mayoría de las reacciones químicas hay flujo de energía entre el sistema y su campo de influencia, por lo cual podemos extender la definición de reacción química e involucrar la energía cinética (calor) como un reactivo o producto.
Aunque hay una gran variedad de ramas de la química, las principales divisiones son:
Es común que entre las comunidades académicas de químicos la química analítica no sea considerada entre las subdisciplinas principales de la química y sea vista más como parte de la tecnología química. Otro aspecto notable en esta clasificación es que la química inorgánica sea definida como "química no orgánica". Es de interés también que la Química Física es diferente de la Física Química. La diferencia es clara en inglés: "chemical physics" y "physical chemistry"; en español, ya que el adjetivo va al final, la equivalencia sería:
- Química física
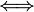 Physical Chemistry
Physical Chemistry - Física química
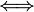 Chemical physics
Chemical physics
La gran importancia de los sistemas biológicos hace que en nuestros días gran parte del trabajo en química sea de naturaleza bioquímica. Entre los problemas más interesantes se encuentran, por ejemplo, el estudio del desdoblamiento de las proteínas y la relación entre secuencia, estructura y función de proteínas.
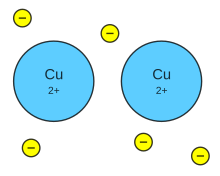
Si hay una partícula importante y representativa en la química es el electrón. Uno de los mayores logros de la química es haber llegado al entendimiento de la relación entre reactividad química y distribución electrónica de átomos, moléculas o sólidos. Los químicos han tomado los principios de la mecánica cuántica y sus soluciones fundamentales para sistemas de pocos electrones y han hecho aproximaciones matemáticas para sistemas más complejos. La idea de orbital atómico y molecular es una forma sistemática en la cual la formación de enlaces es entendible y es la sofisticación de los modelos iniciales de puntos de Lewis. La naturaleza cuántica del electrón hace que la formación de enlaces sea entendible físicamente y no se recurra a creencias como las que los químicos utilizaron antes de la aparición de la mecánica cuántica. Aun así, se obtuvo gran entendimiento a partir de la idea de puntos de Lewis.






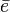 un
un  .
.